Cây thuốc, Y HỌC CỔ TRUYỀN
Hoạt tính sinh học của cây Quyển bá trường sinh(Trường Sinh Thảo)
Khảo sát một số hoạt tính sinh học của cây Trường Sinh Thảo (Quyển bá) Selaginella tamariscina (Beauv.) Spring. thu hái ở Cổ Thạch, Bình Thuận
Đỗ Ngọc Bảo Trân, Lê Thị Mỹ Tiên, Đinh Minh Hiệp, Quách Ngô Diễm Phương

Tóm tắt
Cây Trường Sinh Thảo hay còn gọi là cây quyến bá trường sinh Selaginella tamariscina (Beauv.) Spring. là một loài cây từ lâu đã được dân gian sử dụng đế chữa các bệnh về xương khớp, xuất huyết, viêm gan và bỏng. Tuy nhiên, hiện nay ở Việt Nam, loài quyến bá (Trường Sinh Thảo) trường sinh vẫn chưa được quan tâm nghiên cứu đúng mức mặc dù đã có rất nhiều nghiên cứu về loài này trên thế giới. Do đó, bài báo tập trung nghiên cứu một số hoạt tính sinh học như kháng oxy hóa, kháng khuẩn, chống biến tính protein của 6 loại cao chiết (rễ, lá, toàn cây chiết bằng ethanol; rễ, lá, toàn cây chiết bằng Petroleum ether) từ quyến bá trường sinh thu hái tại vùng biến Cổ Thạch, Bình Thuận và định tính sơ bộ thành phần hóa học của chúng. Định tính sơ bộ cho thấy cây Selaginella tamariscina có chứa hầu hết các hợp chất thứ cấp như phenolic, alkaloid, flavonoid, steroid, glycoside, và lactone. Kết quả nghiên cứu hoạt tính kháng khuẩn cho thấy cao ethanol rễ có khả năng kháng khuẩn tốt hơn các loại cao chiết còn lại. Đối với hoạt tính kháng oxy hóa, cao ethanol rễ có khả năng khử sắt và khả năng trung hòa gốc tự do DPPH tốt nhất, với EC50 = 1,590 ± 0,091 mg/ml. Về hoạt tính chống biến tính albumin, cao petroleum ether toàn cây cho kết quả tốt nhất với IC50 = 99 ± 5 pg/ml.
Từ khóa—Quyến bá trường sinh, Selaginella tamariscina, kháng khuẩn, kháng oxy hóa, chống biến tính protein
1 GIỚI THIỆU
Quyên bá trường sinh (Trường Sinh Thảo) Selaginella tamariscina (Beauv.) Spring. là một loài cây thân thảo, mọc thành búi, có khi kết bện với các giá rễ thành một gốc cao. Cây sinh sản bằng bào tử hoặc nảy chổi từ thân. Cây có hai loại bào tử: đại bào tử (macrospore) nằm trong túi bào tử cái (megasporanges) và tiêu bào tử (microspore) nằm trong túi bào tử đực (microsporanges). Mỗi loại túi bào tử có một loại bào tử diệp riêng biệt [5, 10]. Trong nước, S. tamariscina được tìm thấy trên đất và đá khô cằn vùng đồi núi, núi thấp ven biên các tỉnh miền Trung như Khánh Hòa, Ninh Thuận, Bình Thuận [3]. Trên thế giới, S. tamariscina được người dân Trung Quốc phát hiện và đã được sử dụng như một loại thuốc cổ truyền từ rất lâu [19]. Ngoài ra, S. tamariscina còn phân bố ở các nước Nhật Bản (được đưa vào nghệ thuật bonsai trang trí khá phổ biến), Triều Tiên, Mông Cổ, Hàn Quốc, Bắc Ấn Độ và một số nước khu vực Đông Nam Á [7, 14]. Trong dân gian, cây thường được dùng đê trị viêm gan, vàng da, phỏng, cầm máu, vàng mắt, tắc mật, có tác dụng bổ máu [10].
Đã có nhiều nghiên cứu trên thế giới về thành phần hóa học của Selaginella tamariscina (Beauv.) Spring. Cao chiết của S. tamariscina có chứa một số hợp chất như biflavonoid, selaginellin, lignin, lignan, lignanoside, alkaloid, glycoside, C-glucosylflavone, terpenoid, sterol, polyphenol. Trong đó biflavonoid là hợp chất chính của chi Selaginella và được nghiên cứu nhiều nhất. Selaginella tamariscina chứa một lượng lớn các hợp chất biflavonoid, bao gồm amentoflavone, hinokiflavone, 2′,8”- biapigenin, isocryptomerine, sumaílavone, và taiwaniaflavone [15, 21]. Một điều đáng chú ý, trong khi amentoflavone là hợp chất biílavonoid được tìm thấy ở đa số các loài Selaginella thì sumaílavone chỉ thu được từ S. tamariscina [8, 20]. Cao chiết S. tamariscina đã được chứng minh có nhiều hoạt tính, thí dụ như kháng oxy hóa, kháng viêm, kháng vi sinh (nấm, virus, vi khuẩn), chống tia UV, chống dị ứng và có thể có ảnh hưởng đến chu kỳ sinh sản [14]. Tuy nhiên, ở Việt Nam, loài cây này chưa được tập trung nghiên cứu nhiều về hoạt tính sinh học. Do đó, việc nghiên cứu các hoạt tính sinh học (kháng oxy hóa, kháng khuẩn, chống biến tính protein) đồng thời định tính sơ bộ thành phần hóa học của cây quyển bá trường sinh Selaginella tamariscina (Beauv.) Spring. là rất cần thiết, cũng như tạo nên sự quan tâm đối với loài thực vật này ở Việt Nam.
2 VẬT LIỆU VÀ PHƯƠNG PHÁP
Vật liệu
Cây thảo mộc trường sinh Selaginella tamariscina (Beauv.) Spring. được thu mua tại Cổ Thạch, tỉnh Bình Thuận.
Điều chế cao
Phương pháp điều chế cao được thực hiện theo kỹ thuật chiết ngâm dầm (maceration). Cây quyển bá sau khi thu mua được rửa sạch, phơi trong mát đến khi khối lượng không đổi, chia ra làm ba phần (rễ, lá và toàn cây) rồi xay nhuyễn làm bột khô. Mỗi loại bột được chia làm hai phần, một phần ngâm dầm trong bình thủy tinh có nắp đậy với dung môi ethanol, một phần với dung môi petroleum ether, để yên trong 24 giờ ở nhiệt độ phòng. Thu phần dung dịch chiết qua giấy lọc, tiếp tục cho dung môi mới vào bình và tiếp tục quá trình chiết đến khi chiết kiệt. Thu hồi dung môi bằng cô quay chân không để có được cao chiết chứa các hợp chất tự nhiên của cây [12].
Khảo sát hoạt tính kháng khuẩn
Thí nghiệm khảo sát hoạt tính kháng khuẩn của các loại cao chiết được thực hiện dựa vào phương pháp của Bauer (1966) [2] trên 7 chủng vi khuẩn: Staphylococcus areus, Bacillus subtilis, Streptococcus sp., Acetobacterium sp., Escherichia coli, Pseudomonas aeruginosa, Salmonella typhi. Vi khuẩn được hoạt hóa trong môi trường LB (Luria – Bertani) lỏng và nuôi cấy dịch huyền phù vi khuẩn cho đến khi đạt OD625 bằng 0,5 hoặc hơn, sau đó điều chỉnh dịch huyền phù vi khuẩn đến OD625 bằng 0,5. Tiếp theo, 100pl dịch khuẩn được trải đều trên mỗi đĩa petri, dùng ống nhôm đục lỗ mặt thạch đã trải khuẩn. Sau đó, hút 50pl dung dịch pha loãng các cao khác nhau trong DMSO (Dimethyl sulfoxide) ở nồng độ 50mg/ml, 100mg/ml và 150mg/ml, kanamycin pha trong DMSO và nước cất hai lần ở nồng độ 0,6mg/ml, cho vào từng lỗ đã đục. Tiếp theo, cho 50pl DMSO vào lỗ đối chứng âm. Các đĩa này được ủ trong 24 giờ ở 37oC, và chỉ tiêu theo dõi là đường kính vòng kháng khuẩn (mm) được tính bằng cách lấy tổng đường kính vòng kháng khuẩn mẫu trừ cho đường kính của lỗ.
Khảo sát khả năng khử sắt theo Yen & Duh (1993)
Khả năng khử sắt của cao chiết các mẫu được khảo sát theo phương pháp Yen & Duh (1993) [22]. Cho 2,5ml dung dịch đệm sodium phosphate 0,2M pH 6,6 vào 1ml cao chiết được pha loãng trong DMSO thành nồng độ 4mg/ml. Lắc đều rồi bổ sung 2,5ml dung dịch K3(Fe(CN)6) 1%. Hỗn hợp phản ứng được ổn định ở nhiệt độ 50oC trong thời gian 20 phút. Sau đó, thêm vào hỗn hợp phản ứng 2,5ml TCA (Trichloroacetic acid) 10%. Lắc đều các hỗn hợp phản ứng, sau đó lọc qua giấy lọc để loại bỏ kết tủa, thu lấy dịch nổi. Hút 1ml dịch nổi cho vào ống nghiệm khác, thêm 2ml nước cất và 0,5ml dung dịch FeCl3 10%. Lắc đều hỗn hợp trên rồi để yên trong thời gian 5 phút. Sau cùng, dịch phản ứng được đem đo độ hấp thu ở bước sóng 700nm.
Khảo sát khả năng trung hòa gốc tự do DPPH
Thí nghiệm khảo sát khả năng trung hòa gốc tự do DPPH được thực hiện với tất cả các loại cao chiết, sau đó chọn loại cao chiết có khả năng làm mất màu DPPH cao nhất để xác định EC50 (Effective concentration, nồng độ hiệu quả trung bình). Cao được pha loãng bằng DMSO ở các nồng độ liên tiếp, hút 0,5ml mỗi dịch pha loãng vào từng ống nghiệm riêng với đối chứng âm là DMSO thay cao chiết. Thêm lần lượt vào môi ống nghiệm 3ml ethanol tuyệt đối và 0,5ml dung dịch DPPH được pha trong DMSO ở nồng độ 0,6 mM. Lắc đều hỗn hợp, ủ tối 30 phút ở nhiệt độ phòng. Sau đó đem các dung dịch đo độ hấp thu ở bước sóng 517nm. Khả năng làm mất màu DPPH của mẫu được tính theo công thức: % mất màu DPPH = 100* (Ac – At)/Ac, với Ac là độ hấp thu của đối chứng âm và At là của các cao chiết bằng ethanol ở các nồng độ khác nhau
Khảo sát khả năng chống biến tính protein
Khả năng chống biến tính protein của cao chiết được thực hiện trên albumin huyết thanh bò (bovine serum albumin) dựa trên phương pháp của Wilham và cộng sự (2008) [17] có điều chỉnh. Cao chiết được pha loãng bằng DMSO 5% ở các nồng độ khác nhau. Cho vào ống nghiệm 2 ml đệm acetate pH 5,5, 1ml dung dịch BSA 0,16% (Bovine serum albumin pha trong đệm acetate pH 5,5) và 1ml dung dịch cao chiết đã pha loãng. Đối chứng âm là DMSO 5% thay cho cao chiết. Đối chứng dương là dichlofenac sodium pha trong DMSO 5% cũng được pha loãng ở các nồng độ khác nhau. Sau đó, hỗn hợp được ủ ở 37oC trong 20 phút, mẫu được đo độ hấp thu ở bước sóng 660nm. Tiếp theo, gia nhiệt hỗn hợp lên 67oC trong 5 phút. Sau 5 phút, các ống mẫu được xả dưới vòi nước cho đến khi nguội và mẫu được đo độ hấp thu ở bước sóng 660nm. Khả năng chống biến tính protein được tính theo công thức: % ức chế = 100 * [(Ac67 -AC37) – (A67 – A37)]/ (Ac67 – AC37), với Ac67 là độ hấp thu của đối chứng âm sau khi biến tính ở 67oC, AC37 là độ hấp thu của đối chứng âm sau khi ủ ở 37oC, A67 là độ hấp thu của mẫu sau khi biến tính ở 67oC và A37 là độ hấp thu của mẫu sau khi ủ ở 37oC.
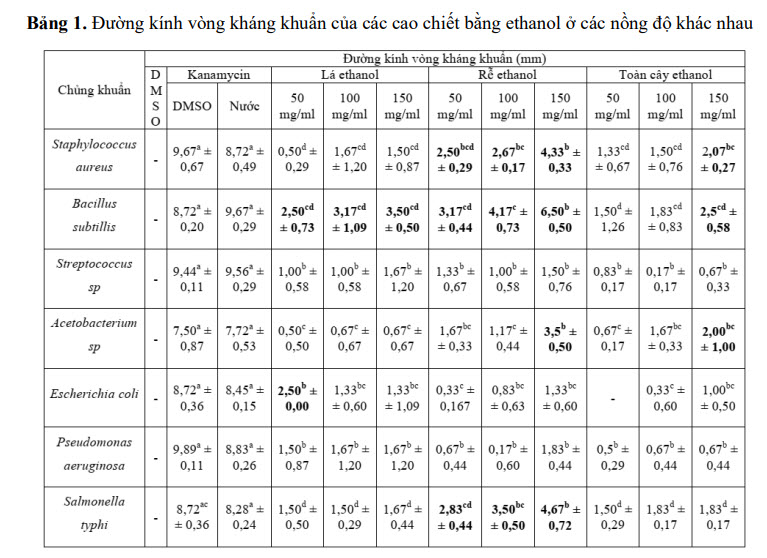
Ghi chú: (-): không có hoạt tính; Kết quả được so sánh theo hàng. Các số trung bình trong hàng •với các mâu tự khác nhau (a, b, c, d) thì khác biệt cóý nghĩa ởmứcp=0,05 độ hấp thu của mẫu có cao chiết tại nồng độ xác định [11].
Định tính một số nhóm hợp chất thứ cấp chính có trong cao chiết
Các cao chiết được xác định nhanh một số nhóm chất thường gặp trong nguyên liệu thực vật như phenol (quinone, coumarin, tannin), alkaloid, flavonoid, terpenoid – steroid, glycoside, … qua các phản ứng hóa học đặc trưng như phản ứng kết tủa, phản ứng tạo màu, … [12].
Phương pháp xử lý thống kê
Số liệu thu được từ các thí nghiệm trong nghiên cứu này được xử lý thống kê bằng phần mềm SPSS và Microsoft Office Excel. Kết quả thí nghiệm được trình bày dưới dạng: giá trị trung bình ± sai số.
3 KẾT QUẢ VÀ THẢO LUẬN
Hoạt tính kháng khuẩn của cao chiết cây Selaginella tamariscina
Các cao chiết cây Selaginella tamariscina dùng trong thí nghiệm này được pha loãng với DMSO ở các nồng độ 50mg/ml, 100mg/ml, và 150mg/ml. Tuy nhiên, cao chiết bằng dung môi petroleum ether không có bất kỳ vòng kháng khuẩn nào. Đối với cao chiết bằng ethanol, kết quả được trình bày ở Bảng 1.
Nhìn chung, hoạt tính kháng khuẩn của các cao chiết yếu. Với hầu hết các chủng vi khuẩn Gram dương, cao ethanol rễ có hoạt tính kháng mạnh nhất trong ba loại cao. Đối với chủng Bacillus subtiUis, các loại cao có tác dụng kháng mạnh hơn hẳn so với các chủng khác (đường kính vòng kháng khuẩn của cao rễ là 6,5±0,5mm ở nồng độ 150mg/ml). Khả năng kháng tỉ lệ thuận với nồng độ cao. Trong đó cao chiết từ rễ có hoạt tính kháng khuẩn cao nhất, sau đó là lá, cao chiết toàn cây có hoạt tính yếu hơn. Điều này cũng được nhận thấy ở chủng Staphylococcus aureus, đường kính vòng kháng khuẩn của cao ethanol rễ lên tới 4,33±0,33mm trong khi ở cao ethanol lá chỉ khoảng 1,5±0,87mm ở cùng nồng độ 150mg/ml. Tương tự với chủng Acetobacterium sp., cũng ở nồng độ đó, đường kính vòng kháng của cao ethanol rễ là 3,5±0,5mm còn vòng kháng của cao ethanol lá chỉ ở mức 0,67±0,67mm. Trong khi đó, các cao chiết có tác dụng kháng khuẩn gần như nhau đối với chủng Streptococcus sp.
Xét về các chủng Gram âm, cũng dễ dàng nhận thấy cao rễ ethanol có tác dụng kháng mạnh hơn đối với Salmonella typhi (ở cùng nồng độ 150mg/ml, đường kính vòng kháng của cao ethanol lá chỉ 1,67±0,44mm trong khi ở rễ lên đến 4,67±0,72mm). Còn ở chủng Pseudomonas aeruginosa, hoạt tính các cao chiết tương đối ngang nhau và rất thấp. Chỉ ở chủng Escherichia coli, cao ethanol lá có hoạt tính kháng mạnh hơn rễ và toàn cây.
Như vậy, cao ethanol các bộ phận cây S. tamariscina có khả năng kháng khuẩn thấp đối với cả chủng vi khuẩn Gram âm và Gram dương. Tuy nhiên với các chủng vi khuẩn sử dụng trong thí nghiệm, có thể thấy các chủng Gram dương bị kháng nhiều hơn. Đồng thời, rễ là bộ phận có hoạt tính kháng khuẩn tốt hơn lá và toàn cây.
S. tamariscina chứa lượng lớn các hợp chất nhóm biílavonoid, trong đó amentoílavone là chủ yếu [15]. Theo Hwang và cộng sự, amentoílavone có hoạt tính kháng khuẩn đối với Staphylococcus aureus, mạnh hơn nhiều so với Escherichia coli và Pseudomonas aeruginosa [6]. Ngoài ra, hợp chất isocryptomerin phân lập từ S. tamariscina cũng đã được chứng minh có khả năng kháng được cả vi khuẩn Gram dương và Gram âm, nồng độ ức chế tối thiểu đối với Staphylococcus aureus là 10pg/ml, nhỏ hơn so với kanamycin 32 lần (320pg/ml) [9]. Tuy nhiên, cao chiết Selaginella tamariscina sử dụng trong nghiên cứu này lại có khả năng kháng khuẩn thấp, có thể do đây là cao chiết thô nên hoạt tính kháng khuẩn thấp hơn nhiều so với các hợp chất tinh được phân lập.
Khả năng khử sắt của cao chiết cây Selaginella tamariscina
Phương pháp kháng oxy hóa dựa trên khả năng khử sắt được sử dụng trong bước đầu khảo sát hoạt tính kháng oxy hóa của các loại cao. Cao chiết của các bộ phận được hòa tan bằng dung môi DMSO với nồng độ 4mg/ml, đối chứng dương là vitamin C với nồng độ 0,5mg/ml và đối chứng âm là DMSO. Trong các loại cao, cao ethanol rễ có hoạt tính cao nhất, sau đó là cao ethanol lá và thấp nhất là cao ethanol toàn cây. Điều này cũng trùng khớp với kết quả thí nghiệm kháng khuẩn. Vùng rễ tích trữ nhiều các hợp chất thứ cấp, tiêu biểu trong cây S. tamariscina là các hợp chất flavonoid và phenolic có hoạt tính kháng oxy hóa. Còn ba loại cao petroleum ether ít có sự khác biệt về độ hấp thu ở OD700 so với đối chứng âm chứng tỏ hàm lượng hợp chất chống oxy hóa rất thấp (Hình 1).

Khả năng trung hòa gốc tự do DPPH của tất cả các loại cao chiết được thử nghiệm ở nồng độ
2mg/ml với các hiệu suất trung hòa gốc tự do DPPH (hiệu suất tính bằng tỷ lệ giảm độ hấp thu quang phổ của DPPH ở bước sóng 517nm) DPPH thể hiện ở Bảng 2.
Bảng 2. Hiệu suất trung hòa gốc tự do DPPH của các loại cao chiết Selaginella tamariscina ở nồng độ 2mg/ml
|
Mẫu thử |
Vitamin C | Cao
ethanol rễ |
Cao
ethanol lá |
Cao ethanol toàn cây | Cao
petroleum ether rễ |
Cao
petroleum ether lá |
Cao
petroleum toàn cây |
| Hiệu suất trung hòa gốc tự do | 95,86% | 57,86% | 43,32% | 47,54% | 8,31% | 11,65% |
10,85% |
Trong các loại cao chiết, cao ethanol rễ có hiệu suất trung hòa gốc tự do DPPH cao nhất (57,86%), do đó tiến hành xác định EC50 của cao ethanol rễ (tại các nồng độ 2mg/ml, 1mg/ml, 0,5mg/ml, 0,25mg/ml, 0,125mg/ml, 0,063mg/ml và 0mg/ml) và vitamin C làm đối chứng dương (tại các nồng độ 0,25mg/ml, 0,12 5mg/ml, 0,063mg/ml, 0,031mg/ml và 0,016mg/ml). Khả năng trung hòa gốc tự do DPPH của cao ethanol rễ và vitamin C tại các nồng độ khác nhau được thể hiện ở Hình 2.
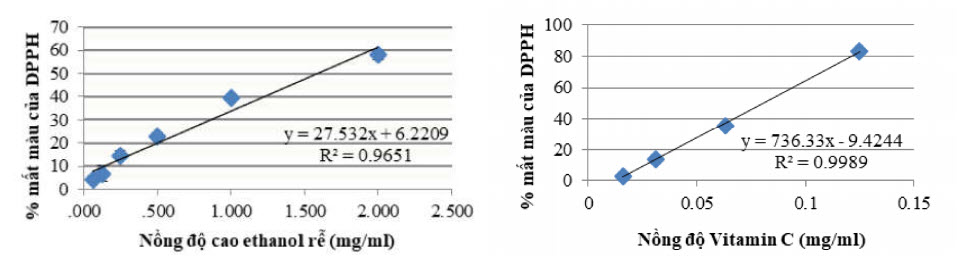
Giá trị EC50 của cao ethanol rễ được tính là 1,590±0,091mg/ml, của vitamin C là 80,600±0,001mg/ml. Với giá trị EC50 này, có thể thấy hoạt tính kháng oxy hóa của cao chiết rễ ethanol khá thấp, thấp hơn khoảng 19,7 lần so với vitamin C. Trong một nghiên cứu gần đây của Yue và Kang (2011), khi tiến hành khảo sát hoạt tính kháng oxy hóa của amentoílavone (AF), phân đoạn ethyl acetate (STEA) và phân đoạn acid (STAE) tách từ S. tamariscina bằng phương pháp trung hòa gốc tự do DPPH, ATBS và thử năng lực khử FRAP cũng đã kết luận cả AF, STEA và STAE đều không có khả năng trung hòa gốc tự do trong phản ứng DPPH. Bên cạnh đó AF và STEA trong thí nghiệm FRAP cũng thể hiện năng lực khử sắt rất yếu [23]. Ethanol là dung môi có độ phân cực lớn, hòa tan được đa số hợp chất, do đó cao ethanol rễ cây S. tamariscina có thể chứa những hợp chất có trong phân đoạn STEA, do đó kết quả của hai thí nghiệm tương đối trùng khớp. Như vậy, cao ethanol rễ S. tamariscina ít có tiềm năng kháng oxy hóa.
Khả năng chống biến tính protein của cao chiết cây Selaginella tamariscina
Sự biến tính protein là một trong những nguyên nhân dẫn đến tình trạng viêm. Phenylbutazone, salicylic acid, flufenamic acid có tác dụng với sự biến tính protein do nhiệt tùy vào nồng độ sử dụng. Do vậy, trong việc khảo sát tiềm năng kháng viêm của một chất, khả năng chống biến tính protein là một hoạt tính cũng cần được quan tâm [16].
Thí nghiệm tiến hành với các dãy nồng độ khác nhau ở các loại cao chiết tùy theo khả năng chống biến tính protein để xác định giá trị IC50.
Thí nghiệm chỉ thu được kết quả tốt nhất ở bốn loại cao: petroleum ether rễ, petroleum ether lá, petroleum ether toàn cây, và ethanol lá. Còn lại hai cao ethanol rễ và ethanol toàn cây do ở nồng độ khá cao (từ 0,125mg/ml đến 2,5mg/ml), phần trăm chống biến tính protein vẫn thấp (gần như tương đương nhau giữa các nồng độ, không có biểu hiện tăng hoặc giảm), phần trăm chống biến tính albumin của cao ethanol rễ ở nồng độ 1,5mg/ml là 28,245±2,775%, với cao ethanol toàn cây ở nồng độ 1,5mg/ml là 33,758±0,525%, nên có thể kết luận hai loại cao này có khả năng chống biến tính protein thấp.
Trong thí nghiệm này, dichlofenac được sử dụng làm đối chứng dương. Dichlofenac là một loại thuốc N SAID phổ biến trong các điều trị liên quan đến kháng viêm. Một viên thuốc dichlofenac thương mại có khối lượng 223mg, trong đó lượng dichlofenac thực là 75mg (còn lại là tá dược). Thí nghiệm tiến hành xác định giá trị IC50 của hợp chất để chứng minh phương pháp thí nghiệm ổn định và hoạt động có hiệu quả.
Giá trị IC50 của dichlofenac được xác định là 0,082±0,014mg/ml, cao petroleum ether rễ là 0,182±0,012mg/ml, của cao petroleum ether lá là 0,473±0,083mg/ml, cao Petroleum ether toàn cây là 0,099±0,005mg/ml và của cao ethanol lá là 1,583±0,033mg/ml (Hình 3).
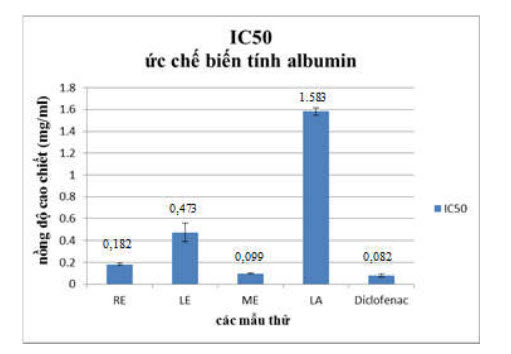
các loại cao chiết và diclfenac
Ghi chú: RE: Cao Petroleum ether rễ; LE: Caopetroleum ether
lá; ME: Cao Petroleum ether toàn cây, LA: Cao ethanol lá
Giá trị IC50 của cao chiết petroleum ether toàn cây và petroleum ether rễ đều khá thấp (dưới 0,2mg/ml). Trong đó, cao chiết petroleum ether toàn cây có giá trị IC50 gần bằng với IC50 của dichlofenac, chỉ cao hơn IC50 của dichlofenac 1,2 lần. Tiếp đến là cao petroleum lá có giá trị IC50 vào khoảng trung bình. Cao ethanol lá có giá trị IC50 cao hơn hẳn ba loại cao còn lại. Như vậy, các cao chiết bằng petroleum ether có khả năng ức chế biến tính albumin tốt hơn hẳn cao chiết bằng ethanol. Điều này trùng khớp với một số nghiên cứu khác về kháng viêm bằng phương pháp tương tự.
Vivek và cộng sự (2015) [16] khi nghiên cứu hoạt tính kháng viêm của cao chiết bằng nhiều loại dung môi của cây Cassia kleinii (petroleum ether, chloroform, ethanol và nước) đã đưa ra kết luận cao chiết bằng petroleum ether có khả năng chống biến tính protein tốt nhất, với phần trăm chống biến tính albumin của cao gần bằng với dichlofenac ở cùng nồng độ. Cao chiết bằng petroleum ether của cây này chứa các thành phần như chất béo, dầu, phytosterol, oxanthrone và triterpene. Trong đó, phytosterol và triterpene đã được chứng minh là có thể ngăn chặn quá trình viêm [1, 4].
Wong và cộng sự (2015) [18] khi so sánh khả năng ức chế biến tính albumin của các cao chiết cây Musa sapientum bằng các dung môi khác nhau cũng nhận thấy cao chiết bằng hexane có hoạt tính cao hơn các cao chiết bằng dung môi phân cực và phân cực trung bình. Các hợp chất trong cao chiết bằng hexane có khả năng chống biến tính protein và kháng viêm là các chất không phân cực. Điều này cho thấy các hợp chất không phân cực có vai trò gắn vào albumin và bảo vệ albumin không bị biến tính bởi nhiệt. Một trong những hợp chất đó đã được xác định là triglycerides, đã được chứng minh là có khả năng kháng viêm [13].
Williams và cộng sự [17] đã xác định được trên BSA (bovine serum albumin) có vùng giàu tyrosine, lysine và threonine đóng vai trò như vị trí gắn các nhân tố kháng viêm. Khi xem xét cơ chế chống biến tính protein của các hợp chất không phân cực, ông cho rằng chúng có thể bảo vệ BSA không bị biến tính bởi nhiệt theo cách này.
Như vậy, cao chiết petroleum ether của S. tamariscina có thể chứa các hợp chất không phân cực có khả năng ức chế biến tính albumin như các nghiên cứu trên. Trong đó, rễ có hoạt tính cao hơn lá, điều này cũng phù hợp với các thí nghiệm kháng khuẩn và kháng oxy hóa. Có thể thấy hoạt tính của cao chiết toàn cây gần bằng với chất chuẩn là dichlofenac chứng tỏ S. tamariscina rất có tiềm năng trong việc hỗ trợ điều trị các bệnh về viêm.
Định tính một số nhóm hợp chất thứ cấp chính có trong cao chiết Selaginella tamariscina
Dựa vào Bảng 3, có thể thấy hầu hết các bộ phận cây S. tamariscina đều có chứa các hợp chất thứ cấp như phenol (quinone, coumarine, tannin) có ở toàn cây (nhưng không xuất hiện trong cao petroleum ether); alkaloid có ở rễ; flavonoid ở toàn cây (rễ có hầu hết các chất trong nhóm flavonoid; ílavone, isoflavone, isoflavanone, flavanol, chalcone, leucoanthocyanin, aurone, chalcon có thể có ở lá; cao ether của rễ chỉ phát hiện isoílavone, isoílavanone, aurone); steroid chỉ có ở rễ (trong cả cao chiết ethanol và petroleum ether); lactone vòng 5 ở toàn cây và glycoside có ở toàn cây trong cả hai loại cao. Cây S. tamariscina không có saponin.
Bảng 3. Kết quả thí nghiệm định tính một số nhóm hợp chất chính
| Nhóm hợp chất | Thuốc thử/ nhóm chất | Ethanol | Ether | |||||
| định tính | Rễ | Lá | Toàn cây | Rễ | Lá | Toàn cây | ||
| FeCĨ3 | + | + | + | – | – | – | ||
| Phenol | Bortrager | + | + | + | – | – | – | |
| Tanin | + | + | + | – | – | – | ||
| Alkaloid | Wagner | + | – | + | – | – | – | |
| H2SO4 đđ | + | + | + | + | – | – | ||
| 1% NaOH/et | + | + | + | – | – | – | ||
| 2% AlCh/et | – | – | – | – | – | – | ||
| Flavonoid | Chì acetate | + | + | + | + | – | + | |
| Wilstatter (phản ứng cyanidin) | Mg | + | + | + | – | – | – | |
| Zn | + | + | + | – | – | – | ||
| Terpennoid-
Steroid |
Rosenheim | – | – | – | – | – | – | |
| Salkowski | + | – | – | + | – | – | ||
| Saponin | – | – | – | – | – | – | ||
| Lactone vòng 5 | Baljet | + | + | + | – | – | – | |
| Molisch | + | + | + | + | + | + | ||
| Glycoside | Trim-Hill (thuốc thử iridoid | |||||||
| aglycone) | ||||||||
Đa số các nghiên cứu về hợp chất tự nhiên chiết từ S. tamariscina chứng tỏ cây chứa nhiều trong S. tamariscina đều liên quan đến ílavonoid. các hợp chất nhóm này [15]. Điều này tương thích Nhiều loại ílavonoid mới được phát hiện và tách với kết quả định tính trên.
4 KẾT LUẬN
Xét về tổng thể, cây Selaginella tamariscina có chứa hầu hết các hợp chất thứ cấp như phenolic, alkaloid, flavonoid, steroid, glycoside, lactone. Tuy nhiên steroid và alkaloid chỉ phát hiện ở rễ mà không phát hiện được ở lá.
Thông qua các thí nghiệm khảo sát hoạt tính, cây Selaginella tamariscina đã được chứng minh là có khả năng kháng khuẩn, kháng oxy hóa thấp và khả năng chống biến tính protein tốt. Trong đó, cao ethanol các bộ phận của cây có khả năng kháng cao hơn đối với các chủng vi khuẩn Bacillus subtittis, Salmolnella typhi và Staphylococcus aureus, trong đó kháng mạnh nhất đối với chủng B. subtiũis. Rễ có hoạt tính kháng khuẩn cao hơn lá và toàn cây ở hầu hết các chủng khuẩn. Đối với hoạt tính kháng oxy hóa, cao ethanol rễ có khả năng kháng oxy hóa cao nhất, tuy nhiên giá trị EC50 bắt gốc tự do DPPH của cao ethanol rễ cao gấp 19,7 lần so với vitamin C. Về hoạt tính chống biến tính albumin, nhóm đã xác định được giá trị IC50 của bốn loại cao (ba loại cao petroleum ether và cao ethanol lá), trong đó cao petroleum ether toàn cây cho kết quả tốt nhất với IC50 = 99±5^g/ml, chỉ cao hơn đối chứng dương là dichlofenac 1,2 lần. Điều này chứng tỏ S. tamariscina có tiềm năng lớn trong việc sử dụng để hỗ trợ điều trị các bệnh về viêm do hoạt tính ức chế biến tính albumin thể hiện hoạt tính kháng viêm của các loại cao chiết.
Nguồn bài viết
TẠP CHÍ PHÁT TRIỂN KHOA HỌC & CÔNG NGHỆ: CHUYÊN SAN KHOA HỌC Tự NHIÊN, TẬP 2, SỐ 2,2018
http://stdjns.scienceandtechnology.com.vn/index.php/stdjns
TÀI LIỆU THAM KHẢO
[1] T. Akihisa, K. Yasukawa, H. Oinuma, Y. Kasahara, S. Yamanouchi, M. Takido, K. Kumaki, and T. Tamura, “Triterpene alcohols from the flowers of compositae and their anti-inflammatory effects”, Phytochemistry, vol. 43, no. 6, pp. 1255-1260, 1996.
[2] A.W. Bauer, W.M.M. Kirby, J.C. Sherris, M. Turck, “Antibiotic susceptibility testing by a standardized single disk method”, American Journal of Clinical Pathology, vol. 45, no. 4, pp. 493-499, 1966.
[3] Bộ Khoa học và Công nghệ, “Phần II. Thực vật”, Sách đỏ Việt Nam, Nhà xuất bản Khoa học Tự nhiên và Công nghệ, Việt Nam, 2007.
[4] L.L. Gao, S.L. Yin, Z.L. Li, Y. Sha, Y.H. Pei, G. Shi, Y.K. Jing, H.M. Hua, “Three novel sterols isolated from Selaginella tamariscina with antiproliferative activity in Leukemia cells”, Planta Medica, vol. 73, pp. 1112-1115, 2007.
[5] H.H. Phạm, Cây cỏ Việt Nam, quyển 1, NXB Trẻ, Việt Nam, 1999, pp. 26.
[6] J.H. Hwang, H. Choi, E.R. Woo, D.G. Lee, “Antibacterial effect of amentotlavone and its synergistic effect with antibiotics”, J. Microbiol. Biotechnol, vol. 23, no. 7, pp. 953-958, 2013.
[7] S.V. Jovanovic, M.G. Simic, “Antioxidants in nutrition”, Annals of the New York Academy of Sciences, vol. 899, pp. 326-334, 2000.
[8] A.O. Lavinsky, P.C. Magalhddess, R.G. Asvila, M.M. Diniz, T.C. Souza, “Partitioning between primary and secondary metabolism of carbon allocated to roots in our maze genotypes under water deficit and its effects on productivity”, The Crop Journal, vol. 3, pp. 379-386, 2015.
[9] J.Y. Lee, Y.J. Choi, E.R. Woo, D.G. Lee, “Antibacterial and synergistic activity of isocryptomerin isolated from Selaginella tamariscina”,J. Microbiol. Biotechnol., vol. 19, no. 2, pp. 204-207, 2009.
[10] T.L. Đỗ, Những cây thuốc và vị thuốc Việt Nam, Nhà xuất bản Y học, 2004.
[11] P. Molyneux, “The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity”, Songklanakarin J. Sci. Technol, vol. 26, no. 2, pp. 211-219, 2004.
[12] K.P.P. Nguyễn, Phương pháp cô lập hợp chất hữu cơ, Nhà xuất bản Đại học Quốc gia TP. Hồ Chí Minh, 2007.
[13] J. Ren, J.L. Shi, C.C. Han, Z.Q. Liu, J.Y. Guo, “Isolation and biological activity of triglycerides of the fermented mushroom of Coprinus Comatus ”, BioMed Central, vol. 12, no. 52, 2012.
[14] A.D. Setyawan, “Review: Recent status of Selaginella (Selaginellaceae) research in Nusantara”, Biodiversitas, vol. 12, no. 2, pp. 112-124, 2011a.
[15] A.D. Setyawan, “Natural products from Genus Selaginella (Selaginellaceae)”, Nusantara Bioscience, vol. 3, pp. 44-58, 2011b.
[16] D. Vivek, M. Mathew, D.A. Sarala, B. Vatakkeel, S.T.K. Mohammed, S.P.N. Kumar, K. Sreerạ, “In vitro anti-inflammatory activity of Cassia kleinii”, Journal of Chemical and Pharmaceutical Research, vol. 7, no. 12, pp. 145-149, 2015.
[17] L. Williams, A. O’Connar, L. Latore, O. Dennis, S. Ringer, J. Whittaker, J. Conrad, B. Vogler, H. Rosner, W. Kraus, “The in vitro anti-denaturation effects induced by natural products and non-steroidal compounds in heat treated (Immunogenic) bovine serum albumin is proposed as a screening assay for the detection of anti-inflammatory compounds, without the use of animals, in the early stages of the drug discovery process”, West Indian Med J, vol. 57, no. 4, pp. 327-331,2008.
[18] T.M. Wong, M. Robinson, S. Hibbert, and L.A.D. Williams, “Isolation of anti-inflammatory compounds from Musa sapientum (Banana) leaf extracts using the anti-denaturation of bovine serum albumin (BSA) assay”, Research Signpost, vol. 37/661, no.2, pp. 33-47, 2015.
[19] C. Yang, Y. Shao, K. Li, W. Xia, “Bioactive selaginellins from Selaginella tamariscina (Beauv.) Spring.”, Beilstein J. Org. Chem, vol. 8, pp. 1884-1889, 2012.
[20] J.S. Yang, C.W. Lin, C.H. Hsin, M.J. Hsieh, Y.C. Chang, “Selaginella tamariscina Attenuates Metastasis via Akt Pathways in Oral Cancer Cells”, PLoS ONE, vol. 8, no. 6, 2013.
[21] J.W. Yang, Y.R. Pokharel, M.R. Kim, E.R. Woo, H.K. Choi, K.W. Kang, “Inhibition of inducible nitric oxide synthase by sumaílavone isolated from Selaginella tamariscina.”, J. Ethnopharmacol., vol. 105, no. 1-2, pp. 107-113, 2006.
[22] G. Yen, P. Duh, “Antioxidative Properties of methanolic extracts from peanut hulls”, Journal of the American Oil Chemists’Society, vol. 70, no. 4, pp. 383-386, 1993.
[23] S.M. Yue, W.Y. Kang, “Lowering blood lipid and hepatoprotective activity of amentoflavone from Selaginella tamariscina in vivo”, Journal of Medicinal PlantsResearch, vol. 5, no. 14, pp. 3007-3014, 2011.
Biological activities of spike moss Selaginella tamariscina (Beauv.) Spring. collected from Co Thach, Binh Thuan
Do Ngoc Bao Tran1, Le Thi My Tien1, Dinh Minh Hiep1, Quach Ngo Diem Phuong1*
1University of Science, VNUHCM
*Corresponding author: qndphuong@hcmus.edu.vn Received: 10-04-2017; Accepted: 17-6-2018; Published: 30-8-2018
preliminary phytochemical screening results show that Selaginella tamariscina extracts have most of secondary metabolite groups such as phenolics, alkaloids, tlavonoids, steroids, and lactone. The antibacterial activity ot the ethanol extract ot root is higher than that ot other extracts. Moreover, the ethanol extract ot root also has the highest reducing ability and tree radical scavenging activity, with EC50 = 1.590 ± 0.091mg/ml. In the anti-denaturation ot albumin test, the Petroleum ether extract ot whole plant has the lowest IC50 at 99 ± 5^g/ml.
Abstract—In Vietnam, Selaginella tamariscina (Beauv.) Spring. has been used as a traditional medicine for osteoarthritis, haemorrhage, hepatitis, burn, … However, Selaginella tamariscina is less studied than in other countries. Therefore, this research focuses on study some bioactivities (such as antioxidative, antibacterial activities, and inhibition of albumin denaturation) and preliminary phytochemical screening of six extracts (ethanol extracts of root, leaf, whole plant, petroleum extracts of root, leaf, whole plant) of S. tamariscina collect from Co Thach, Binh Thuan Province. The
Index Terms—Spike moss, Selaginella tamariscina, antibacterial, antioxidative, anti-denaturation of protein

